La Via del Ferro – Giovedì Salute
La prima cosa che faccio quando mi arriva un paziente è valutare l’ENERGIA vitale. Questa dipende da molti fattori, fra quelli più importanti c’è la capacità di OSSIGENAZIONE, ecco che la questione emoglobina e ferro va sempre valutata.
IL FERRO CARENTE causa le ANEMIE
Ci sono una serie di condizioni in cui è facile trovare Anemia e carenza di ferro:
TALASSEMIA
MICI (malattie infiammatorie croniche intestinali)
GASTRITI ULCERE
MESTRUAZIONI ABBONDANTI
FIBROMI, ENDOMETRIOSI
DISTRIBUZIONE
4 gr nel corpo : di cui 65% emoglobina , 10% mioglobina, 20% Fegato, Midollo osseo Milza
ASSORBIMENTO
carenze di Ferro in circa il 5% della popolazione
- nel duodeno e nel primo tratto del digiuno
- Il miglior assorbimento di ferro si ha quando il cibo contiene ferro in forma eminica (carne).
- Il ferro non-eminico degli alimenti è solitamente in stato ferrico (+3) e deve essere ridotto a stato ferroso (+2) e liberato dal legame alimentare dalle secrezioni gastriche. L’assorbimento del ferro non emico è ridotto da altri prodotti alimentari (p. es., i latticini, i fitati e i polifenoli delle fibre vegetali, i tannati del tè, comprese le fosfoproteine, la crusca) e alcuni antibiotici (p. es., le tetracicline).
- VITAMINA C: si lega al ferro trivalente ferrico >> formando un composto che favorisce l’assorbimento, cosi pure alcuni acidi deboli come il tartarico,
- ACIDO LATTICO da fermentazione favorisce assorbimento ferro
ACIDITA’ DELLO STOMACO : >> ferrico >> ferroso, inibito dagli antiacidi
ALCOOL > assorbimento ferro : riducendo sintesi epatica epcidina
FITATI : cereali legumi, basta ammollarli con limone
- È sufficiente 1 mg AL GIORNO per mantenere l’omeostasi del ferro
- in allattamaneto gravidanza infanzia il fabbisogno aumenta ED AUMENTA L’ASSORBIMENTO INTESTINALE (via soppressione epcidina)
- di quello ingerito ne assorbiamo circa il 10%
Una delle proteine che permette l’assorbimento è la DMT1 che permette il trasporto dei cationi bivalenti (can carica ++), ecco perchè il ferro 3+ deve essere trasformato da ferro 3+ a Fe 2+, per essere riconvertito in 3+ per legarsi alla transferrina
Tutti i Cationi bivalenti 2+, vanno in competizione l’uno con l’altro, ecco perché i sali vanno diluiti molto.
Fe++
Ca++
Mg ++
Mn++
Cd++
FATTORI DA CONSIDERARE
Riassumendo ci sono 4 fattori da considerare:
- DIETA : la dieta meglio che contenga delle proteine animali che hanno un ferro più assimilabile.
- STOMACO e INTESTINO: gastriti o bassa acidità indotta da farmaci o malattie, Intestino infiammato
- EMORAGGIE, mestruazioni abbondanti, o da endometriosi
TRASFERIMENTO
dalla MUCOSA INTESTINALE >> TRANSFERRINA (sintetizzata nel fegato)
trasporta il Fe +++
>> ERITROBLASTI (GLOBULI ROSSI) , FEGATO , PLACENTA
negli eritroblasti viene accoppiato il Fe+++ con protoporfirina IX per trasformarla in eme. l’EME nei mitocondri
La transferrina si riduce con le patologie croniche (infiammazione cronica)
emivita di 8 gg
SATURAZIONE DELLA TRANSFERRINA
SIDEREMIA / (TRANSFERRINA X 1,42) x 100
Valori normali uomo: 20-50%
Valori normali donna: 15-50%
sono 3 i parametri
Nella pratica clinica, si dosano i seguenti parametri:
- Sideremia: quota di transferrina circolante satura in ferro;
- Transferrinemia: dosaggio diretto della transferrina a livello plasmatico;
- Capacità totale di legare il ferro (TIBC): misura indiretta della capacità della transferrina di legare il ferro.
La sideremia misura la quantità di ferro di trasporto presente nel sangue.
L’UIBC esprime la capacità di riserva della transferrina, vale a dire la frazione proteica che non è ancora stata saturata con il ferro; questo parametro ematochimico può essere calcolato direttamente o tramite la formula: TIBC – sideremia.
Che cos’è l’emocromatosi?
Esistono quattro forme di emocromatosi ereditaria (detta anche emocromatosi primitiva o emocromatosi idiopatica), note con i nomi di emocromatosi di tipo 1, di tipo 2, di tipo 3 e di tipo 4. L’emocromatosi di tipo 2, conosciuta anche come emocromatosi giovanile, è una forma piuttosto severa che insorge precocemente e, se non trattata, può portare alla morte entro i trenta anni di età.
La patologia può però avere alla base diverse altre cause – malattie come le anemie sideroblastiche, la talassemia e l’epatopatia alcolica -oppure altre condizioni come l’eccessiva assunzione di ferro: in questi casi si parla di emocromatosi secondaria.
L‘eccesso di ferro nell’organismo può arrivare a provocare gravi danni come cirrosi epatica, diabete, scompenso cardiaco, aritmie, artropatie e osteoporosi. Nell’uomo può portare a impotenza e nella donna all’amenorrea, e in entrambi può provocare la sterilità.
L’organo che soffre maggiormente per l’accumulo di ferro è il fegato
L’EME
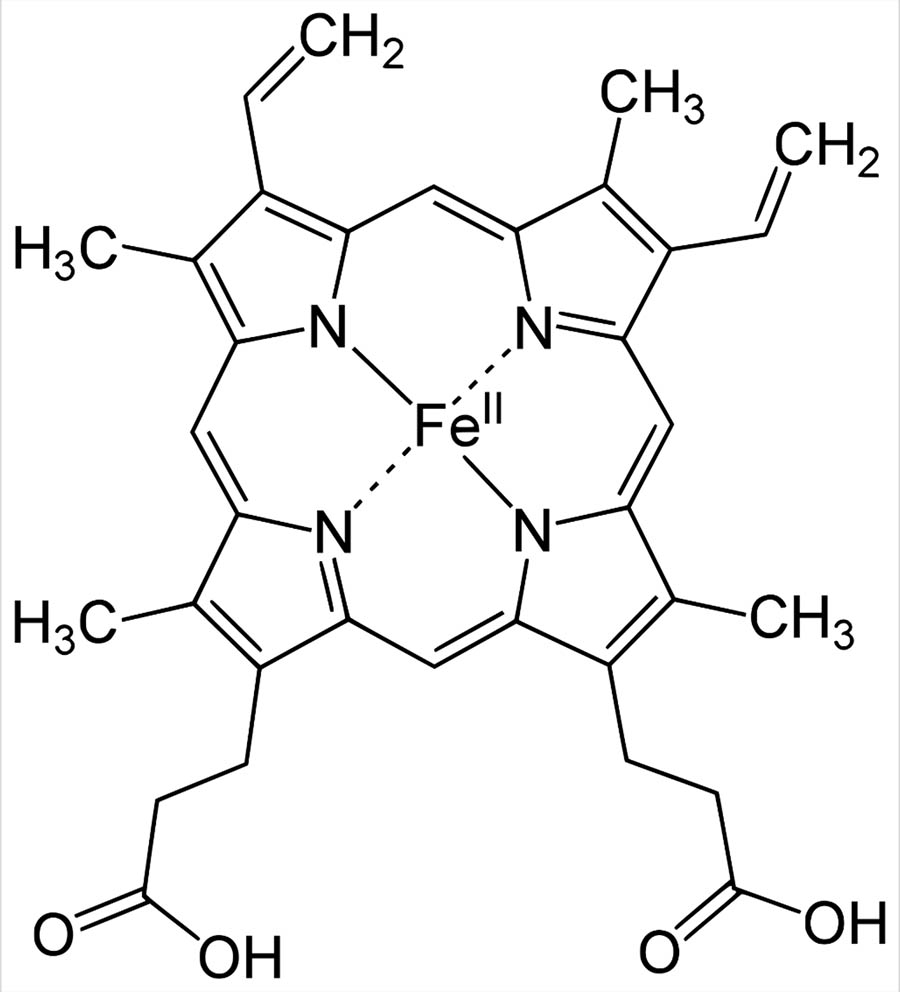
è un modo per legare in modo reversibile l’ossigeno e lo troviamo :
nell’EMOGLOBINA per il trasporto dell’ossigeno nel sangue
nella MIOGLOBINA per l’imagazzinamento del ferro nei muscoli
nei COMLESSI ENZIMATICI della CATENA DI OSSIDAZIONE nei MITOCONDRI.
ACCUMULO
il ferro viene immagazzinato in 2 forme:
La forma più importante di stoccaggio è la ferritina (un gruppo eterogeno di proteine che circondano un nucleo di ferro), che rappresenta una frazione di riserva solubile e di pronto utilizzo situata nel fegato (negli epatociti), nel midollo osseo e nella milza (nei macrofagi); nei globuli rossi; e nel siero
EMOSIDERINA relativamente insolubile e viene immagazzinata in primo luogo nel fegato (nelle cellule di Kupffer) e nel midollo osseo (nei macrofagi).
DEGRADAZIONE
I GLOBULI ROSSI hanno una emivita di 3 mesi : quindi vanno in emolisi e vanno degradati e riutilizzate le varie parti
L’eme libero ha il principale effetto di indurre la formazione di ROS (specie reattive dell’ossigeno), provocando danno ossidativo all’ambiente. Pertanto è necessario che la cellula catabolizzi rapidamente le specie di scarto.
Dopo l’emolisi, l’emoglobina liberamente rilasciata nel sangue viene dapprima captata dall’aptoglobina (Hp), formando il complesso Hb/Hp, che viene endocitato dalle cellule del sistema reticoloendoteliale via il trasportatore CD163 (la componente proteica viene degradata ad amminoacidi e il gruppo prostetico viene liberato). Quando la disponibilità di Hp va incontro a esaurimento, l’eme viene rilasciato dall’impalcatura proteica, e quindi captato dall’albumina, da HDL/LDL o dall’emopessina (Hx), che analogamente a Hp contribuisce ad accrescere il pool di eme libero nelle cellule adibite al suo catabolismo, attraversando il trasportatore CD91.[3]
L’eme libero viene degradato dall’enzima eme ossigenasi (HO-1/2) che porta alla formazione di bilirubina, un potente agente antiossidante di colore giallognolo. L’eme dei globuli rossi viene invece degradato nella milza. Più correttamente, dall’apertura dell’anello porfirinico si origina prima biliverdina e ossido di carbonio, con rilascio dell’atomo di ferro centrale; la biliverdina, poi, viene convertita a bilirubina dall’enzima biliverdina reduttasi.
Notare che dalla degradazione dell’anello viene generato ossido di carbonio, noto gas tossico che ha elevata affinità per l’eme stesso. La reale funzione di questo gas nel sito di produzione è, invece, modulare delle risposte metaboliche postume al catabolismo dell’eme, come la respirazione cellulare (citocromo mitocondriale) e la produzione del secondo messaggero GMP ciclico.
La bilirubina presente nel sangue viene captata dal fegato, coniugata con acido glucuronico e quindi espulsa con la bile nel tratto intestinale. Qui si trasforma nei bilinogeni incolori (urobilinogeno, mesobilirubinogeno e stercobilinogeno) e quindi in biline (urobilina e stercobilina), responsabili della colorazione delle feci.
Romano Visentin Biologo




